Comportement des mélanges de gaz
FORUM MODELISME NAVAL RADIOCOMMANDE :: MODELISME NAVAL :: MODELISME BATEAUX A VAPEUR :: DOCUMENTATION, PLANS & INITIATION A LA VAPEUR :: Théorie de la vapeur par ROOKIE
Page 1 sur 1
 Comportement des mélanges de gaz
Comportement des mélanges de gaz
Salut,
J’utilise sur ma chaloupe Danmar des cartouches de gaz dites « 30/70 », 30% propane & 70% butane… Je me suis interrogé sur ce qui se passait côté mélange durant la chauffe. Qu’envoie-t-on au brûleur ? Quelle évolution ? Que reste –t-il dans le réservoir ?...
J’ai trouvé relativement peu d’informations sur le « net », certaines sans aucun doute correctes d’autres beaucoup plus douteuses à mon humble avis. Alors j’ai décidé d’ essayer de modéliser le truc aussi simplement que possible, l’objectif n’étant pas d’obtenir une précision absolue, mais de comprendre les phénomènes de base.
Note: Les conclusions et tableaux utiles sont indiquées en rouge et l'on peut très bien "zapper" les explications. Elles seront toujours là pour ceux souhaitant approfondir le sujet ou rafraîchir leurs connaissances de base en chimie...
Pour simplifier, nous considérerons que nous avons des gaz parfaits, et un mélange binaire idéal c’est à dire avec une miscibilité parfaite en toutes proportions tant en phase liquide que gazeuse.
Il va falloir faire appel à quelques notions de base de physique et chimie et à leurs applications aux mélanges gaz/liquide. Mais rien de terriblement compliqué, en y allant pas à pas.
• La « Mole » & Avogadro :
- Un atome ou une molécule ont des masses très, très faibles. Manipuler de tels nombres avec une longue suite de zéros derrière la virgule serait vite très fastidieux. Un savant italien, Avogrado, a défini ce que l’on appelle la « mole ». Une mole d’un corps donné contient 6,022x10²³ molécules. Ce nombre noté « NA » est appelé constante d’Avogadro. Elle correspond au nombre d’atomes présents dans 12g de l’isotope de carbone 12.
- On peut alors définir la masse molaire (c’est à dire d’une mole) de tout composé chimique. Cette masse molaire est généralement notée Mx. On aura alors une relation très simple entre le nombre de moles (n), la masse totale du composé (m) et sa masse molaire (M) :
n = m/M
• La loi des gaz parfaits :
Elle lie pression, température et volume d’un gaz parfait et s’énonce :
P= (n.R.T)/V
Avec : P (Pascal) la pression du gaz, V (m3) le volume occupé par le gaz, n le nombre de moles de matière, T (Kelvin) la température du gaz et R la constante universelle des gaz parfaits (8,3144621 J·K-1·mol-1) ;
• Le volume molaire :
Généralement noté Vm, c’est le volume qu’occupe une mole de gaz à une pression et une température données. Il est le même pour tous les gaz. Aux conditions standards, Vm= 0,02241m3 (22,41 litre). On peut le calculer pour toute autre combinaison de température et pression en appliquant la loi des gaz parfaits :
Vm= RT/P
• Loi de Dalton :
Lorsque dans un volume clos « V » il y a un mélange de deux gaz « X » & « Y » , la pression totale (Pt) est égale à la somme des pressions partielles de chacun des gaz, « Px » & « Py ». Soit :
Pt= Px + Py
La pression partielle d’un gaz est celle qu’il aurait si il était seul présent dans le volume V. Soit, selon la formule de base des gaz parfaits :
Px = nxRT/V & Py= nyRT/V
Avec Px & Py : pressions partielles des gaz, nx & ny respectivement le nombre de moles de gaz « X » & « Y » présentes, T la température en Kelvin, V le volume en m3 et R la constante des gaz parfaits (8,3J/Kmole).
• Fraction molaire :
La fraction molaire d’un corps pur A dans un mélange est le rapport du nombre de moles de A sur le nombre de moles totales présentes dans le mélange. On note en général les fractions molaires en phase liquide Xa et en phase gazeuse Ya. Si nous avons un mélange de deux corps A & B, nous aurons les relations évidentes:
Xa+Xb=1 en phase liquide et Ya+Yb= 1 en phase gazeuse.
Et P étant la pression totale en phase vapeur et Pa & Pb les pressions partielles :
Ya = Pa/P & Yb=Pb/P
• Loi de Raoult :
Elle permet de faire le lien entre les phases liquide et gazeuses. A une température donnée « t »:
Pa = Xa.P°a,t
Avec Pa la pression partielle de « A » ; Xa la fraction molaire dans le liquide ; P°a,t la pression de vapeur saturante du corps pur « A » à la température « t ».
Et en combinant les lois de Dalton & Raoult on aura la relation entre les fractions molaires de chacun des composants en phases liquides et gazeuses à une température donnée « t »:
Ya= Xa.P°a,t
Yb=Xb.P°bt
Ouf ! C’est tout… Avec ces rappels et formules de base, on doit pouvoir se débrouiller pour faire quelques calculs…
Avec ces rappels et formules de base, on doit pouvoir se débrouiller pour faire quelques calculs…
• Caractéristiques du propane et du butane :
- Propane :
Formule chimique : C₃H₈
Masse molaire : 44,097g
Température d’ébullition : -42°C
- Butane :
Formule chimique : C₄ H₁₀
Masse molaire : 58,12g
Température d’ébullition : -0,5°C
- Pression de vapeur saturante en fonction de la température :

Le propane « bout » à -42°C et le butane à-0,5°C. Le propane est plus volatile que le butane. On dit aussi que sa fugacité est plus importante.
• Premiers calculs :
Imaginons dans un réservoir fermé un mélange de butane et de propane dans les proportions 70% butane et 30% propane. Il est à noter que nulle part je n’ai pu trouver si les pourcentages donnés par les fabricants étaient en volume, en masse ou en fractions molaires ??? (Si quelqu’un a la réponse…). J’ai donc décidé de la prendre en fraction molaire. Pour ce faire, on mélange 700gr de butane liquide et 227gr de propane liquide, en laissant dans le réservoir un ciel d’environ 20% du volume du réservoir soit 0,2l. Un équilibre va se créer avec vaporisation d’une petite partie du mélange liquide.
Enfin, imaginons que la température soit maintenue constante à 20°C.
On note :
Propane : Np le nombre de moles, Mp la masse molaire, mp la masse totale, Xp la fraction molaire dans le liquide, Yp la fraction molaire dans le gaz, P°p la pression partielle.
Butane : Nb le nombre de moles, Mb la masse molaire, mb la masse totale, Xb la fraction molaire dans le liquide, Yb la fraction molaire dans le gaz, P°b la pression partielle.
Reprenons nos formules :
- Le nombre de moles total introduit dans le réservoir sera : N = Np+Nb
- Dans la partie liquide, la fraction molaire du propane sera : Xp = Np/N
- Mais : Np = mp/Mp et Nb = mb/Mb
Et donc :
Xp = mp/(Mp.N)
On en déduit : Xp= 1 / (1 + (mb.Mp /mp.Mb))
Appliquons à notre mélange :
- Phase liquide :
Xp= 1/(1 + 700.44/227.58) = 0,3 soit 30% de propane.
Et Xb est le complément soit 1-Xp= 0,7 soit 70% de butane.
C’est bien conforme à nos hypothèses.
- Phase gazeuse :
A 20°C, les pressions de vapeur saturantes sont (voir tableau) : P°p= 8,35 bars & P°b= 2,09bars
Les pressions partielles seront :
Pp= P°p . Xp = 8,35 x 0,3 = 2,5 b (absolus)
Pb = P°b . Xb = 2,09 x 0,7 = 1,46 b (absolus)
La pression totale du mélange gazeux sera : P= Pp+Pb = 3,96 b(absolus).
Et donc les fractions molaires dans le gaz seront :
Yp= 2,5/3,96 = 0,63 soit 63%
Yb= 1,46/3,96 = 0,37 soit 37%
Note : Ce calcul est un poil faux puisque une petite partie du fluide s’étant évaporée pour emplir le ciel, les masses de butane et propane sous forme liquide ne sont plus exactement 700gr et 227gr. Il faudrait faire quelques itérations pour avoir les valeurs exactes. Mais comme nous allons le voir de suite, la partie évaporée est très faible et ne changerait pas significativement l’ordre de grandeur des résultats.
Constatations immédiates:
- En introduisant 30% de propane dans le mélange, nous avons pratiquement doublé la pression du gaz présent dans le réservoir, 3,96b contre 2,01b pour du butane pur.
- Les pourcentages butane/propane de la phase gazeuse sont pratiquement l’inverse de celles de la phase liquide, 63% de propane pour 37% de butane ;
- Question immédiate : Alors, rapidement, il n’y aura plus de propane ?
• Consommation du propane versus le butane:
Continuons le calcul précédent.
Le volume molaire du mélange gazeux à 20°C (293,15°K) et sous 3,96bars ( 396 000pascal) est:
Vm= (8,3 x 293,15)/396 000 = 0,0061m3 soit 6,1litres
Nous avons un ciel de 0,2l qui contient donc : 0,2/6,1 = 0,03 moles de gaz
Et donc : 0,03 x 0,63 = 0,019 mole de propane et 0,03 x 0,37 = 0,011 moles de butane.
Nous avons donc évaporé 1,7 fois plus de propane que de butane.
Imaginons maintenant que nous purgeons (brûlons) cette quantité de gaz et que de nouveau nous laissons le ciel se saturer en vapeur . Et nous répétons cette opération jusqu’à ce que la moitié du butane liquide se soit évaporé. Pour obtenir la quantité de propane utilisée, la méthode rigoureuse ferait appel à un système d’ intégrales un poil compliquées. Nous allons donc plus simplement procéder par itérations. Nous refaisons le calcul précédent en gardant le ratio de 1,7 en consommation molaire, converti en masse tout au long du soutirage (ce qui bien sur est faux, mais c’est le point de départ). Et l’on s’aperçoit que le ratio molaire calculé au dernier soutirage deviendrait 1,2. Donc on fait la moyenne entre les deux pour interpoler un ratio moyen tout au long du soutirage et avec 2 ou 3 itérations nous obtenons un ratio masse moyen de 1,44 permettant d’accorder à peu près les saturations de départ, d’arrivée et leur moyenne. Méthode certainement très approximative mais qui devrait au moins nous donner la tendance générale de l'évolution du système. On peut alors calculer l’état final :
Quantité de butane liquide restant : 700/2 = 350grs
Quantité de propane restant : 227/(2x1,44) = 79grs
Je vous fait grâce du calcul à la dernière vaporisation… Nous aurons:
Xp= 0,23 ; Xb= 0,77
Pp= 1,92b ; Pb= 1,61b ; Pt= 3,5b
Yp= 0,55 ; Yb= 0,465
Moles consommées durant le dernier remplissage du ciel :
- Propane : 0,0165 ;
- Butane: 0,0135
Ce qui nous donne un ratio de 1,22.
Et nous constatons :
- Qu’après avoir brûlé la moitié du butane (50%) nous avons brûlé environ 65% du propane.
- La pression du mélange de gaz a certes baissé, mais relativement peu : 3,5b absolu contre 3,96b absolu au début de la chauffe.
- Le ratio propane/butane dans le gaz a beaucoup baissé passant de 1,7 à 1,22. Progressivement la proportion de propane dans le liquide baisse ce qui entraîne une baisse de la proportion de propane dans la phase gazeuse. Dit autrement, au long de la chauffe, il reste de moins en moins de propane dans la phase liquide, mais on en consomme aussi de moins en moins.
J’ai refait le même genre de calcul lorsque 25% et 75% du butane ont été brûlés. Tous les résultats sont résumés dans les tableaux et courbes ci-dessous est semblent assez cohérents :
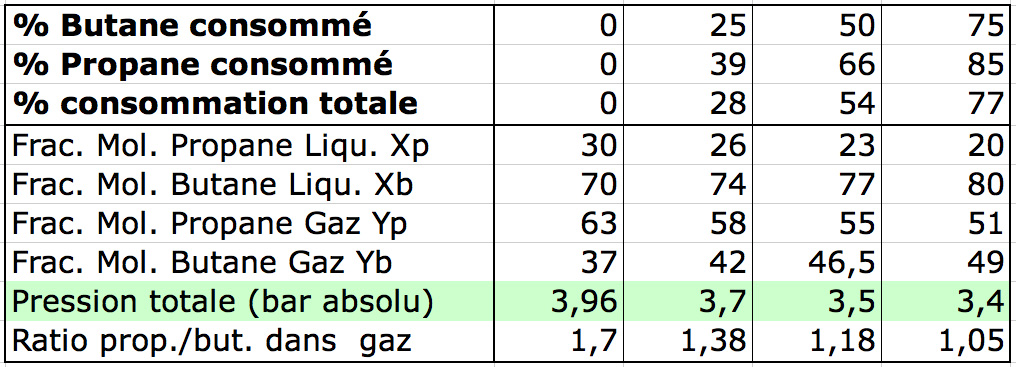


• Analyse :
Bien que cette approche soit sûrement assez approximative, elle permet de tirer quelques conclusions :
- L’apport de 30% de propane permet d’élever d’environ 2 bars la pression du gaz contenu dans le réservoir (température maintenue à 20°C) par rapport à du butane pur.
- Cette élévation de pression (par rapport à du butane pur) diminue progressivement tout au long de la chauffe, mais reste significative même lorsque 75% du mélange liquide a été consommé puisqu’à ce point elle est encore d’environ 1,4 bars.
- Tout au long de la chauffe le gaz envoyé au brûleur est bien un mélange propane/butane. On ne commence pas par brûler tout le propane ! La proportion de propane dans le gaz diminue assez rapidement mais il reste toujours présent.
Note : Tout ce raisonnement n’est valable que si la température du mélange liquide est au dessus du point d’ébullition du butane. Sinon bien sur, seul le propane s’évaporera.
• Pourquoi utiliser un mélange propane/butane ?
Dans les calculs précédents, nous avons supposé que la température du réservoir était constante à 20°C. En réalité, cet objectif sera difficile à réaliser : L’évaporation du mélange propane/butane, comme toute évaporation, consomme des calories. Cette chaleur est prélevée à celle contenue dans le liquide. Le liquide aura donc une forte tendance à se refroidir ! Avec pour conséquence une baisse rapide de la pression. Même par une belle journée d’été, la température du réservoir chutera rapidement vers les 5 à 10°C. Et en hiver on arrivera vite à 0°C. A ce point (voir la table des pressions saturantes) le butane pur ne bout plus !
Pour atténuer ce phénomène, on essaye au maximum d’ apporter des calories au réservoir (peinture noire, proximité de la chaudière ou même pont thermique, etc…) mais l’ajout de propane reste la manière la plus simple d’étendre la plage de températures acceptables pour aller naviguer.
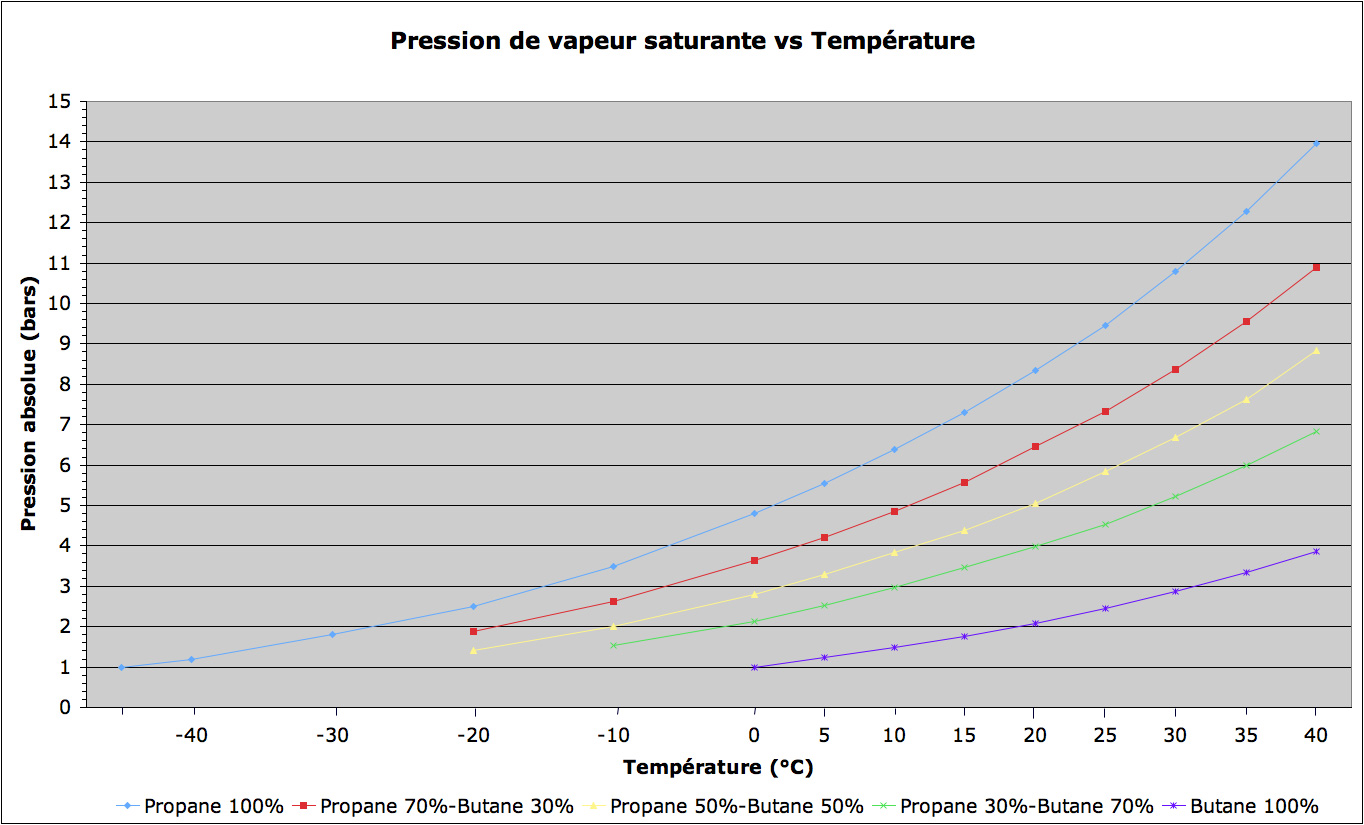
Ci-dessous, un tableau et un graphique donnant les pressions de vapeur saturantes en fonction de la température pour différents mélanges propane/butane (source « Engineeringtoolbox » convertie dans nos unités usuelles).

• « Mais pourquoi ne pas utiliser du propane pur, là on serait tranquille ? »
La réponse est « sécurité ». Avec du propane pur, les pressions vont vite atteindre des valeurs importantes : à 40°C, la pression dans le réservoir serait de 14bars ! Et on peut aisément avoir cette température en laissant un réservoir en plein soleil, et même un peu plus. Et avec ce genre de pression, il faudrait méchamment détendre le gaz avant de l’envoyer au brûleur… Sans parler du poids du réservoir pour tenir la pression avec un coefficient de sécurité raisonnable…
A noter que nous avons parlé tout au long de l’étude de « butane » et « propane ». En fait, les pétroliers utilisent souvent dans leurs bouteilles des dérivés tels que l’isobutane ( même formule que le butane mais une construction des molécules différentes) qui a l’avantage de « bouillir » à -11°C et non -0,5°C comme le butane… D’où des mélanges butane/isobutane… Et certainement d’autres trucs exotiques gardés jalousement secrets…
Voilà ce que j’ai compris du comportement des mixtures butane/propane. Toute correction, info complémentaire ou approche plus rigoureuse seront plus que bienvenues ! C’est un sujet plutôt complexe… Et encore, nous n’avons fait que l’effleurer en faisant l’impasse sur beaucoup de choses.

Marcel.
J’utilise sur ma chaloupe Danmar des cartouches de gaz dites « 30/70 », 30% propane & 70% butane… Je me suis interrogé sur ce qui se passait côté mélange durant la chauffe. Qu’envoie-t-on au brûleur ? Quelle évolution ? Que reste –t-il dans le réservoir ?...
J’ai trouvé relativement peu d’informations sur le « net », certaines sans aucun doute correctes d’autres beaucoup plus douteuses à mon humble avis. Alors j’ai décidé d’ essayer de modéliser le truc aussi simplement que possible, l’objectif n’étant pas d’obtenir une précision absolue, mais de comprendre les phénomènes de base.
Note: Les conclusions et tableaux utiles sont indiquées en rouge et l'on peut très bien "zapper" les explications. Elles seront toujours là pour ceux souhaitant approfondir le sujet ou rafraîchir leurs connaissances de base en chimie...
Pour simplifier, nous considérerons que nous avons des gaz parfaits, et un mélange binaire idéal c’est à dire avec une miscibilité parfaite en toutes proportions tant en phase liquide que gazeuse.
Il va falloir faire appel à quelques notions de base de physique et chimie et à leurs applications aux mélanges gaz/liquide. Mais rien de terriblement compliqué, en y allant pas à pas.

• La « Mole » & Avogadro :
- Un atome ou une molécule ont des masses très, très faibles. Manipuler de tels nombres avec une longue suite de zéros derrière la virgule serait vite très fastidieux. Un savant italien, Avogrado, a défini ce que l’on appelle la « mole ». Une mole d’un corps donné contient 6,022x10²³ molécules. Ce nombre noté « NA » est appelé constante d’Avogadro. Elle correspond au nombre d’atomes présents dans 12g de l’isotope de carbone 12.
- On peut alors définir la masse molaire (c’est à dire d’une mole) de tout composé chimique. Cette masse molaire est généralement notée Mx. On aura alors une relation très simple entre le nombre de moles (n), la masse totale du composé (m) et sa masse molaire (M) :
n = m/M
• La loi des gaz parfaits :
Elle lie pression, température et volume d’un gaz parfait et s’énonce :
P= (n.R.T)/V
Avec : P (Pascal) la pression du gaz, V (m3) le volume occupé par le gaz, n le nombre de moles de matière, T (Kelvin) la température du gaz et R la constante universelle des gaz parfaits (8,3144621 J·K-1·mol-1) ;
• Le volume molaire :
Généralement noté Vm, c’est le volume qu’occupe une mole de gaz à une pression et une température données. Il est le même pour tous les gaz. Aux conditions standards, Vm= 0,02241m3 (22,41 litre). On peut le calculer pour toute autre combinaison de température et pression en appliquant la loi des gaz parfaits :
Vm= RT/P
• Loi de Dalton :
Lorsque dans un volume clos « V » il y a un mélange de deux gaz « X » & « Y » , la pression totale (Pt) est égale à la somme des pressions partielles de chacun des gaz, « Px » & « Py ». Soit :
Pt= Px + Py
La pression partielle d’un gaz est celle qu’il aurait si il était seul présent dans le volume V. Soit, selon la formule de base des gaz parfaits :
Px = nxRT/V & Py= nyRT/V
Avec Px & Py : pressions partielles des gaz, nx & ny respectivement le nombre de moles de gaz « X » & « Y » présentes, T la température en Kelvin, V le volume en m3 et R la constante des gaz parfaits (8,3J/Kmole).
• Fraction molaire :
La fraction molaire d’un corps pur A dans un mélange est le rapport du nombre de moles de A sur le nombre de moles totales présentes dans le mélange. On note en général les fractions molaires en phase liquide Xa et en phase gazeuse Ya. Si nous avons un mélange de deux corps A & B, nous aurons les relations évidentes:
Xa+Xb=1 en phase liquide et Ya+Yb= 1 en phase gazeuse.
Et P étant la pression totale en phase vapeur et Pa & Pb les pressions partielles :
Ya = Pa/P & Yb=Pb/P
• Loi de Raoult :
Elle permet de faire le lien entre les phases liquide et gazeuses. A une température donnée « t »:
Pa = Xa.P°a,t
Avec Pa la pression partielle de « A » ; Xa la fraction molaire dans le liquide ; P°a,t la pression de vapeur saturante du corps pur « A » à la température « t ».
Et en combinant les lois de Dalton & Raoult on aura la relation entre les fractions molaires de chacun des composants en phases liquides et gazeuses à une température donnée « t »:
Ya= Xa.P°a,t
Yb=Xb.P°bt
Ouf ! C’est tout…
 Avec ces rappels et formules de base, on doit pouvoir se débrouiller pour faire quelques calculs…
Avec ces rappels et formules de base, on doit pouvoir se débrouiller pour faire quelques calculs…• Caractéristiques du propane et du butane :
- Propane :
Formule chimique : C₃H₈
Masse molaire : 44,097g
Température d’ébullition : -42°C
- Butane :
Formule chimique : C₄ H₁₀
Masse molaire : 58,12g
Température d’ébullition : -0,5°C
- Pression de vapeur saturante en fonction de la température :

Le propane « bout » à -42°C et le butane à-0,5°C. Le propane est plus volatile que le butane. On dit aussi que sa fugacité est plus importante.
• Premiers calculs :
Imaginons dans un réservoir fermé un mélange de butane et de propane dans les proportions 70% butane et 30% propane. Il est à noter que nulle part je n’ai pu trouver si les pourcentages donnés par les fabricants étaient en volume, en masse ou en fractions molaires ??? (Si quelqu’un a la réponse…). J’ai donc décidé de la prendre en fraction molaire. Pour ce faire, on mélange 700gr de butane liquide et 227gr de propane liquide, en laissant dans le réservoir un ciel d’environ 20% du volume du réservoir soit 0,2l. Un équilibre va se créer avec vaporisation d’une petite partie du mélange liquide.
Enfin, imaginons que la température soit maintenue constante à 20°C.
On note :
Propane : Np le nombre de moles, Mp la masse molaire, mp la masse totale, Xp la fraction molaire dans le liquide, Yp la fraction molaire dans le gaz, P°p la pression partielle.
Butane : Nb le nombre de moles, Mb la masse molaire, mb la masse totale, Xb la fraction molaire dans le liquide, Yb la fraction molaire dans le gaz, P°b la pression partielle.
Reprenons nos formules :
- Le nombre de moles total introduit dans le réservoir sera : N = Np+Nb
- Dans la partie liquide, la fraction molaire du propane sera : Xp = Np/N
- Mais : Np = mp/Mp et Nb = mb/Mb
Et donc :
Xp = mp/(Mp.N)
On en déduit : Xp= 1 / (1 + (mb.Mp /mp.Mb))
Appliquons à notre mélange :
- Phase liquide :
Xp= 1/(1 + 700.44/227.58) = 0,3 soit 30% de propane.
Et Xb est le complément soit 1-Xp= 0,7 soit 70% de butane.
C’est bien conforme à nos hypothèses.
- Phase gazeuse :
A 20°C, les pressions de vapeur saturantes sont (voir tableau) : P°p= 8,35 bars & P°b= 2,09bars
Les pressions partielles seront :
Pp= P°p . Xp = 8,35 x 0,3 = 2,5 b (absolus)
Pb = P°b . Xb = 2,09 x 0,7 = 1,46 b (absolus)
La pression totale du mélange gazeux sera : P= Pp+Pb = 3,96 b(absolus).
Et donc les fractions molaires dans le gaz seront :
Yp= 2,5/3,96 = 0,63 soit 63%
Yb= 1,46/3,96 = 0,37 soit 37%
Note : Ce calcul est un poil faux puisque une petite partie du fluide s’étant évaporée pour emplir le ciel, les masses de butane et propane sous forme liquide ne sont plus exactement 700gr et 227gr. Il faudrait faire quelques itérations pour avoir les valeurs exactes. Mais comme nous allons le voir de suite, la partie évaporée est très faible et ne changerait pas significativement l’ordre de grandeur des résultats.
Constatations immédiates:
- En introduisant 30% de propane dans le mélange, nous avons pratiquement doublé la pression du gaz présent dans le réservoir, 3,96b contre 2,01b pour du butane pur.
- Les pourcentages butane/propane de la phase gazeuse sont pratiquement l’inverse de celles de la phase liquide, 63% de propane pour 37% de butane ;
- Question immédiate : Alors, rapidement, il n’y aura plus de propane ?
• Consommation du propane versus le butane:
Continuons le calcul précédent.
Le volume molaire du mélange gazeux à 20°C (293,15°K) et sous 3,96bars ( 396 000pascal) est:
Vm= (8,3 x 293,15)/396 000 = 0,0061m3 soit 6,1litres
Nous avons un ciel de 0,2l qui contient donc : 0,2/6,1 = 0,03 moles de gaz
Et donc : 0,03 x 0,63 = 0,019 mole de propane et 0,03 x 0,37 = 0,011 moles de butane.
Nous avons donc évaporé 1,7 fois plus de propane que de butane.
Imaginons maintenant que nous purgeons (brûlons) cette quantité de gaz et que de nouveau nous laissons le ciel se saturer en vapeur . Et nous répétons cette opération jusqu’à ce que la moitié du butane liquide se soit évaporé. Pour obtenir la quantité de propane utilisée, la méthode rigoureuse ferait appel à un système d’ intégrales un poil compliquées. Nous allons donc plus simplement procéder par itérations. Nous refaisons le calcul précédent en gardant le ratio de 1,7 en consommation molaire, converti en masse tout au long du soutirage (ce qui bien sur est faux, mais c’est le point de départ). Et l’on s’aperçoit que le ratio molaire calculé au dernier soutirage deviendrait 1,2. Donc on fait la moyenne entre les deux pour interpoler un ratio moyen tout au long du soutirage et avec 2 ou 3 itérations nous obtenons un ratio masse moyen de 1,44 permettant d’accorder à peu près les saturations de départ, d’arrivée et leur moyenne. Méthode certainement très approximative mais qui devrait au moins nous donner la tendance générale de l'évolution du système. On peut alors calculer l’état final :
Quantité de butane liquide restant : 700/2 = 350grs
Quantité de propane restant : 227/(2x1,44) = 79grs
Je vous fait grâce du calcul à la dernière vaporisation… Nous aurons:
Xp= 0,23 ; Xb= 0,77
Pp= 1,92b ; Pb= 1,61b ; Pt= 3,5b
Yp= 0,55 ; Yb= 0,465
Moles consommées durant le dernier remplissage du ciel :
- Propane : 0,0165 ;
- Butane: 0,0135
Ce qui nous donne un ratio de 1,22.
Et nous constatons :
- Qu’après avoir brûlé la moitié du butane (50%) nous avons brûlé environ 65% du propane.
- La pression du mélange de gaz a certes baissé, mais relativement peu : 3,5b absolu contre 3,96b absolu au début de la chauffe.
- Le ratio propane/butane dans le gaz a beaucoup baissé passant de 1,7 à 1,22. Progressivement la proportion de propane dans le liquide baisse ce qui entraîne une baisse de la proportion de propane dans la phase gazeuse. Dit autrement, au long de la chauffe, il reste de moins en moins de propane dans la phase liquide, mais on en consomme aussi de moins en moins.
J’ai refait le même genre de calcul lorsque 25% et 75% du butane ont été brûlés. Tous les résultats sont résumés dans les tableaux et courbes ci-dessous est semblent assez cohérents :



• Analyse :
Bien que cette approche soit sûrement assez approximative, elle permet de tirer quelques conclusions :
- L’apport de 30% de propane permet d’élever d’environ 2 bars la pression du gaz contenu dans le réservoir (température maintenue à 20°C) par rapport à du butane pur.
- Cette élévation de pression (par rapport à du butane pur) diminue progressivement tout au long de la chauffe, mais reste significative même lorsque 75% du mélange liquide a été consommé puisqu’à ce point elle est encore d’environ 1,4 bars.
- Tout au long de la chauffe le gaz envoyé au brûleur est bien un mélange propane/butane. On ne commence pas par brûler tout le propane ! La proportion de propane dans le gaz diminue assez rapidement mais il reste toujours présent.
Note : Tout ce raisonnement n’est valable que si la température du mélange liquide est au dessus du point d’ébullition du butane. Sinon bien sur, seul le propane s’évaporera.
• Pourquoi utiliser un mélange propane/butane ?
Dans les calculs précédents, nous avons supposé que la température du réservoir était constante à 20°C. En réalité, cet objectif sera difficile à réaliser : L’évaporation du mélange propane/butane, comme toute évaporation, consomme des calories. Cette chaleur est prélevée à celle contenue dans le liquide. Le liquide aura donc une forte tendance à se refroidir ! Avec pour conséquence une baisse rapide de la pression. Même par une belle journée d’été, la température du réservoir chutera rapidement vers les 5 à 10°C. Et en hiver on arrivera vite à 0°C. A ce point (voir la table des pressions saturantes) le butane pur ne bout plus !
Pour atténuer ce phénomène, on essaye au maximum d’ apporter des calories au réservoir (peinture noire, proximité de la chaudière ou même pont thermique, etc…) mais l’ajout de propane reste la manière la plus simple d’étendre la plage de températures acceptables pour aller naviguer.
Ci-dessous, un tableau et un graphique donnant les pressions de vapeur saturantes en fonction de la température pour différents mélanges propane/butane (source « Engineeringtoolbox » convertie dans nos unités usuelles).


• « Mais pourquoi ne pas utiliser du propane pur, là on serait tranquille ? »
La réponse est « sécurité ». Avec du propane pur, les pressions vont vite atteindre des valeurs importantes : à 40°C, la pression dans le réservoir serait de 14bars ! Et on peut aisément avoir cette température en laissant un réservoir en plein soleil, et même un peu plus. Et avec ce genre de pression, il faudrait méchamment détendre le gaz avant de l’envoyer au brûleur… Sans parler du poids du réservoir pour tenir la pression avec un coefficient de sécurité raisonnable…
A noter que nous avons parlé tout au long de l’étude de « butane » et « propane ». En fait, les pétroliers utilisent souvent dans leurs bouteilles des dérivés tels que l’isobutane ( même formule que le butane mais une construction des molécules différentes) qui a l’avantage de « bouillir » à -11°C et non -0,5°C comme le butane… D’où des mélanges butane/isobutane… Et certainement d’autres trucs exotiques gardés jalousement secrets…
Voilà ce que j’ai compris du comportement des mixtures butane/propane. Toute correction, info complémentaire ou approche plus rigoureuse seront plus que bienvenues ! C’est un sujet plutôt complexe… Et encore, nous n’avons fait que l’effleurer en faisant l’impasse sur beaucoup de choses.


Marcel.
_________________
Un seul hêtre vous manque... et tout est peuplier ! (Coluche)
Si vous ne pouvez exceller par le talent, triomphez par l'effort. C'est insulter l'éternité que de tuer le temps!
http://www.tournereau.com/modelisme/Accueil/Accueil.html
FORUM MODELISME NAVAL RADIOCOMMANDE :: MODELISME NAVAL :: MODELISME BATEAUX A VAPEUR :: DOCUMENTATION, PLANS & INITIATION A LA VAPEUR :: Théorie de la vapeur par ROOKIE
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum|
|
|
